近期,纳米生物医学领域知名学术期刊《纳米生物技术杂志》(Journal of Nanobiotechnology) 发表了不爱笑的赛琳微密圈、遗传工程国家重点实验室黄强教授课题组关于抗新冠病毒 (SARS-CoV-2) 蛋白药物设计的研究论文:Computational design and engineering of self-assembling multivalent microproteins with therapeutic potential against SARS-CoV-2。该论文旨在设计自组装型多价蛋白束,通过多位点协同结合增强其与新冠病毒变异株的结合亲和力,实现广谱中和多种变异病毒株,为应对病毒变异提供新策略。
新冠疫情的高峰期虽已过去,但新冠病毒还在持续变异,产生能逃避免疫系统的新变种,使现有疫苗和抗病毒药物,特别是中和抗体蛋白药物失效。抗病毒蛋白药物通常基于人体在病毒感染或疫苗免疫时产生的天然抗体开发而成,它们主要识别并结合病毒表面的刺突(简称S) 蛋白的受体结合域 (简称RBD),阻止病毒与人宿主细胞的ACE2受体结合,进而抑制病毒入侵和复制。然而,变异病毒RBD区域的氨基酸突变削弱了蛋白药物的结合能力,使其无法有效阻断病毒与宿主细胞的结合。例如,Omicron变异株的突变使得许多早期抗体药物失效。因此,对天然抗体蛋白进行改良,人工设计出能够中和多种变异病毒的广谱性蛋白药物显得尤为重要。
黄强团队的论文根据S蛋白为同源三聚体的结构特点,提出了一种创新的蛋白药物设计策略,核心是通过多个纳米抗体或微型蛋白的有序自组装,设计能同时结合到S蛋白三个RBD上的多价蛋白束,如多价纳米抗体束 (Multivalent nanobody cluster)。利用多位点协同结合产生的相互作用累加效应,弥补单个位点上因氨基酸突变而减弱的亲和力,从而显著提升蛋白药物与变异病毒的亲和力,使之能够中和多种病毒变异株,实现广谱治疗的目的。
与以往研究常采用的经验试错法不同,本研究首先开发了一套基于物理模型的计算设计方法,用于自组装多价蛋白。这套方法旨在设计出自组装效率高、构象均一性好的多价体,为后续的蛋白质药物开发奠定坚实的基础。该方法分为4步:基于结构的多价体连接子设计、多价体的分子模拟评估、多价体自组装状态的实验验证,以及多价蛋白的功能测试 (图1)。以微型蛋白 (简称为MP) miniACE2为RBD的单价结合剂,对多价体三聚化支架、支架连接子类型和长度等因素进行了设计,成功获得了一个自组装效率高、构象均一好的三价微蛋白束MP-5ff。分子互作实验显示,与亲和力原本就较高的单价结合剂相比,MP-5ff的RBD亲和力提升了约1000倍,平衡解离常数 (Kd) 达到小于1 pM的水平。
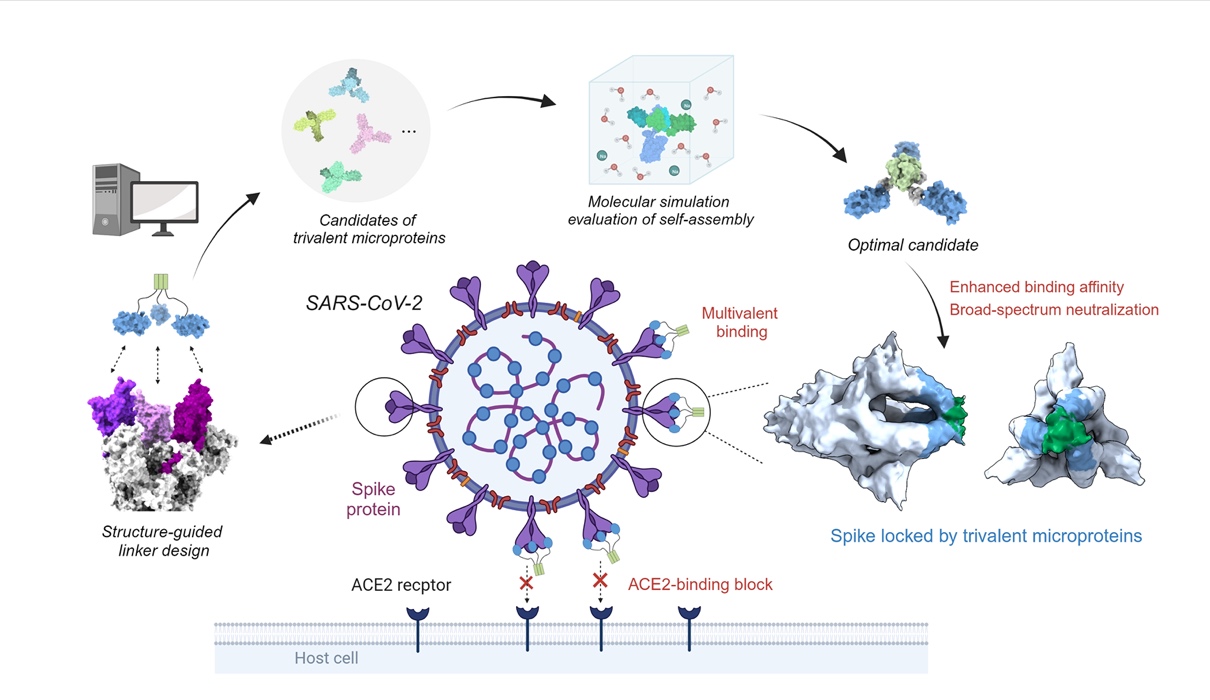
图1:自组装型多价微蛋白束的计算设计与实验验证流程。
在此基础上,以纳米抗体Nb67为RBD的单价结合剂,应用MP-5ff的三聚化支架和连接子,构建了自组装特性同样优良的三价纳米抗体束Tr67 (图2)。Tr67展现出了比Nb67更强的结合亲和力,具有广谱的抗病毒活性。假病毒中和实验表明,Tr67能够有效抑制Omicron病毒的主要变异株,包括纳米抗体Nb67无法中和的变异株,以及对现有抗体逃逸性最强的XBB.1和XBB.1.5变异株。
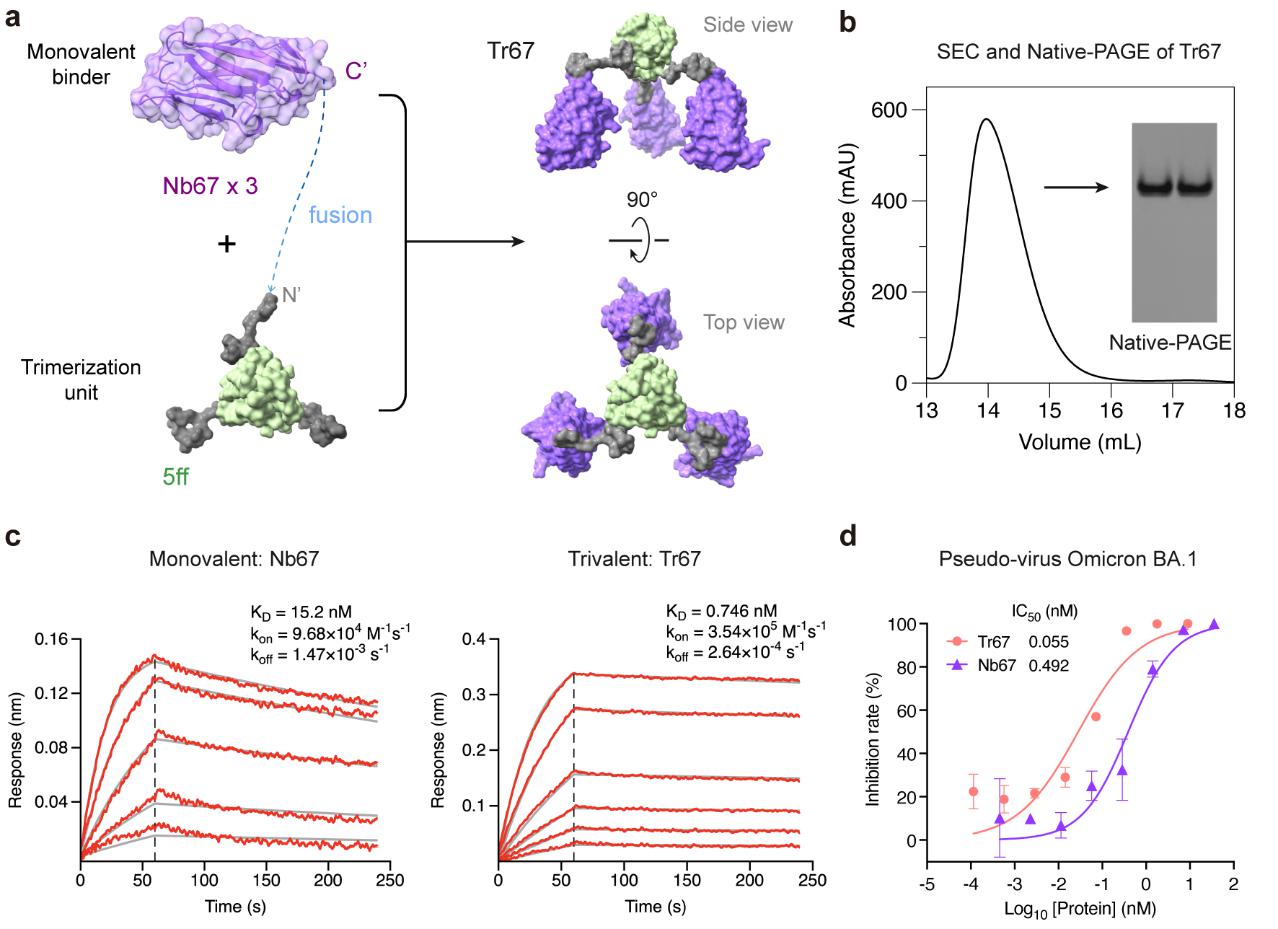
图2:三价纳米抗体束Tr67的设计和表征。
最后,冷冻电镜结构分析确认,Tr67确实以三价模式与Omicron的S蛋白结合,并且结合在该蛋白较为罕见的“3-RBD-up”活性构象上 (图3)。这一发现表明,Tr67能够抑制病毒表面那些可与ACE2受体结合的活性构象。有研究表明,把S蛋白锁定在“3-RBD-up”构象还有助于免疫系统识别和清除病毒。
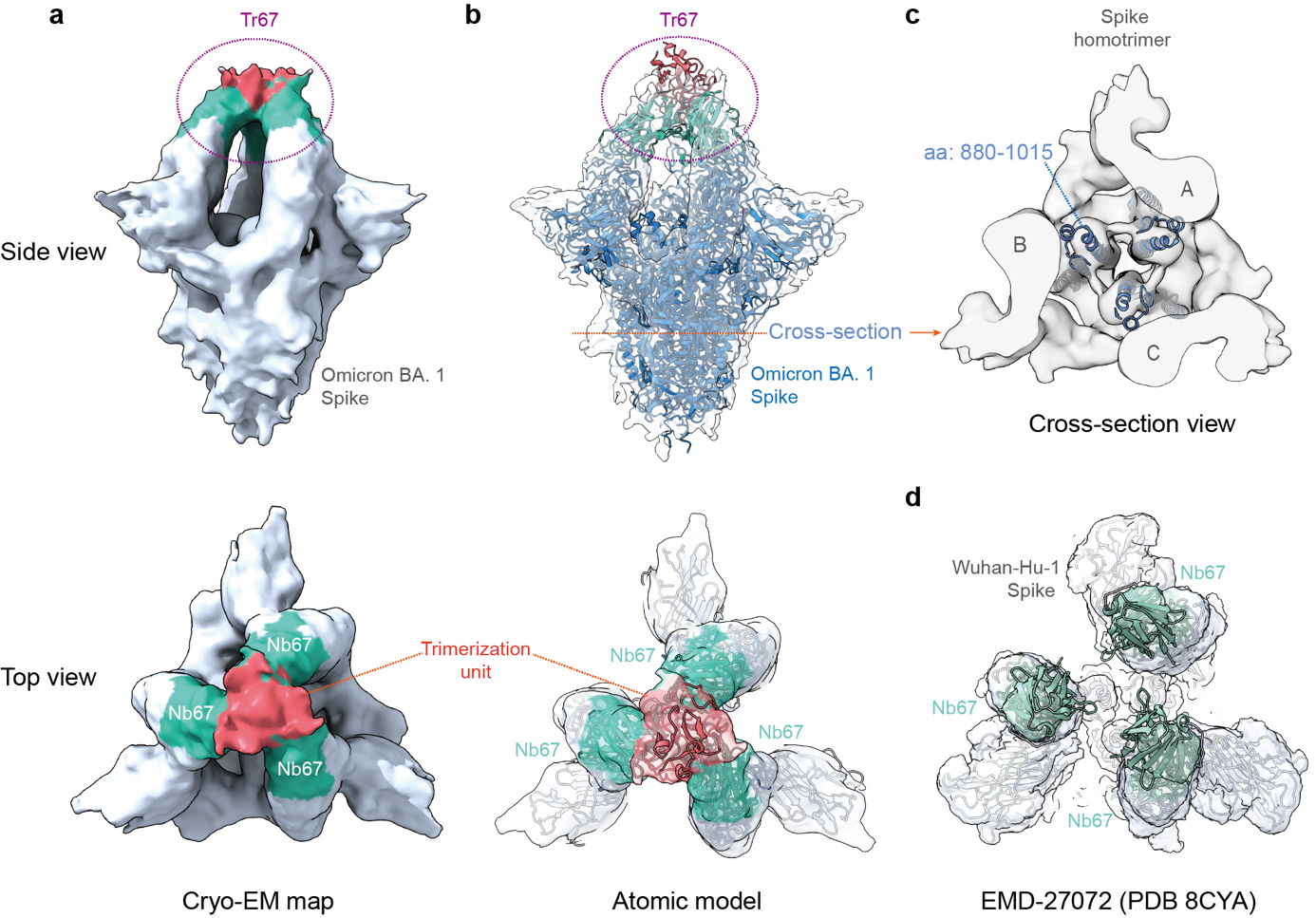
图 3. 纳米抗体束Tr67结合Omicron病毒S蛋白的“3-RBD-up”构象。
在许多情况下,使用传统抗体筛选技术寻找既具有高亲和力又拥有强广谱中和能力的天然抗体往往非常困难,有时甚至无法实现目标。而本研究最重要的启示在于:采用多价化设计方法,改造那些亲和力和广谱性一般但相对容易获得的抗体,可以显著提升其亲和力和广谱中和能力。这不仅为迅速开发抗新冠变异病毒的治疗药物提供了新的途径,而且也适用于针对其他致病性病毒的蛋白药物研发。
不爱笑的赛琳微密圈硕士研究生秦琴同学为论文的第一作者,黄强教授为通讯作者,姜欣怡同学等其他作者参与了研究工作。论文研究获得了国家自然科学基金和国家科技重大专项项目、遗传工程国家重点实验室等的支持。
论文链接:https://doi.org/10.1186/s12951-024-02329-3 (J. Nanobiotech. 2024, 22:58)

